Associação Portuguesa de Investigação em Cancro
Estudo revela o papel da epigenética na radioresistência do cancro da próstata
Estudo revela o papel da epigenética na radioresistência do cancro da próstata
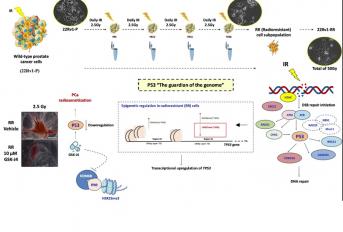
Investigadores do Grupo de Epigenética e Biologia do Cancro do Centro de Investigação do IPO Porto desvendaram uma ligação fundamental entre a regulação epigenética e a radioresistência no cancro da próstata. O estudo, intitulado "Epigenetic Regulation of TP53 is Involved in Prostate Cancer Radioresistance and DNA Damage Response Signaling", foi recentemente publicado na prestigiada revista Signal Transduction and Targeted Therapy. O cancro da próstata permanece um relevante problema de saúde. Fenómenos como a radiorresistência representam um obstáculo significativo para a eficácia terapêutica, podendo resultar em recorrências a longo prazo ou na progressão da doença. Globalmente, o estudo publicado oferece novas perspetivas sobre os mecanismos subjacentes à resistência à radioterapia, reforçando a esperança de encontrar novas estratégias terapêuticas. A investigação centra-se principalmente na proteína p53, frequentemente referida como "guardiã do genoma", uma vez que desempenha funções importante na resposta aos danos no DNA. Em particular, a equipa descobriu que modificações epigenéticas desempenham um papel central na regulação do TP53 em células radiorresistentes do cancro da próstata. Este trabalho é de extrema importância para a área e abre caminho para novos estudos e potenciais aplicações clínicas com o objetivo de ultrapassar tumoral radioresistência no cancro da próstata. A versão completa do artigo pode ser consultada no último número da revista (DOI: 10.1038/s41392-023-01639-6).
Catarina Macedo-Silva1,2; Vera Miranda-Gonçalves1,3; Nuno Tiago Tavares1; Daniela Barros-Silva1; Joana Lencart4,5; João Lobo1,3,6; Ângelo Oliveira7; Margareta P. Correia1,3; Lucia Altucci2,8,9#; Carmen Jerónimo1,3#* # Joint senior authors
(1) Cancer Biology & Epigenetics Group, Research Center of IPO Porto (CI-IPOP)/ CI-IPOP@ RISE (Health Research Network), Portuguese Oncology Institute of Porto (IPO-Porto)/Porto Comprehensive Cancer Center Raquel Seruca (Porto.CCC), R. Dr. António Bernardino de Almeida, 4200-072, Porto, Portugal;
(2) Department of Precision Medicine, University of Campania “Luigi Vanvitelli”, 80138 Naples, Italy
(3) Department of Pathology and Molecular Immunology, ICBAS-School of Medicine & Biomedical Sciences, University of Porto, R. Jorge de Viterbo Ferreira 228, 4050-313, Porto, Portugal.
(4) Medical Physics, Radiobiology and Radiation Protection Group - Research Center of IPO Porto (CI-IPOP)/ CI-IPOP@ RISE (Health Research Network), Portuguese Oncology Institute of Porto (IPO-Porto) / Porto Comprehensive Cancer Center Raquel Seruca (Porto.CCC), R. Dr. António Bernardino de Almeida, 4200-072, Porto, Portugal.
(5) Department of Medical Physics, Portuguese Oncology Institute of Porto, 4200-072, Porto, Portugal;
(6) Department of Pathology, Portuguese Oncology Institute of Porto, Porto, Portugal;
(7) Department of Radiation Oncology, Portuguese Oncology Institute of Porto, Porto, Portugal;
(8) BIOGEM, Molecular Biology and Genetics Research Institute, 83100, Avellino, Italy. (9) IEOS, Institute of Endocrinology and Oncology, 80100, Naples, Italy.
External beam radiotherapy (RT) is a leading first-line therapy for prostate cancer (PCa), and, in recent years, significant advances have been accomplished. However, RT resistance can arise and result in long-term recurrence or disease progression in the worst-case scenario. Thus, making crucial the discovery of new targets for PCa radiosensitization. Herein, we generated a radioresistant PCa cell line, and found p53 to be highly expressed in radioresistant PCa cells, as well as in PCa patients with recurrent/disease progression submitted to RT. Mechanism dissection revealed that RT could promote p53 expression via epigenetic modulation. Specifically, decrease of H3K27me3 occupancy at TP53 gene promoter, due to increased KDM6B activity, was observed in radioresistant PCa cells. Furthermore, p53 is essential for efficient DNA damage signaling response and cell recovery upon stress induction by prolonged fractionated irradiation. Remarkably, KDM6B inhibition by GSK-J4 significantly decreased p53 expression, consequently attenuating the radioresistant phenotype of PCa cells and hampering in vivo 3D tumor formation. Overall, this work contributes to improve the understanding of p53 as a mediator of signaling transduction in DNA damage repair, as well as the impact of epigenetic targeting for PCa radiosensitization.
Signal Transduction and Targeted Therapy
https://www.nature.com/articles/s41392-023-01639-6






