Associação Portuguesa de Investigação em Cancro
Transcriptome Reprogramming of CD11b+ Bone Marrow Cells by Pancreatic Cancer Extracellular Vesicles
Transcriptome Reprogramming of CD11b+ Bone Marrow Cells by Pancreatic Cancer Extracellular Vesicles
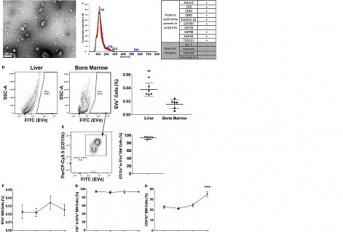
O cancro de pâncreas é a quarta principal causa de mortes relacionadas ao cancro no mundo, apresentando uma taxa de sobrevida de 5 anos de cerca de 6% e uma taxa de sobrevida média de cerca de 6 meses. Entre os cancros pancreáticos, o adenocarcinoma ductal pancreático (CP) é o tipo mais comum e é responsável por mais de 90% dos casos. Uma combinação de fatores leva ao mau prognóstico do CP, incluindo dificuldades na deteção da doença em estágio inicial, seu alto potencial metastático e sua resistência às terapias convencionais. As previsões atuais relatam uma escalada mundial na incidência desta doença e um aumento de mais de duas vezes no número de novos casos de CP, bem como mortes relacionadas, até 2030. Os tumores não existem como entidades isoladas, mas como redes sistêmicas complexas envolvendo a comunicação célula-célula entre células malignas e não malignas. O microambiente criado por células não tumorais pode ser composto tanto por células locais quanto por células recrutadas de locais distantes, como a medula óssea (MO), sendo um componente chave da progressão tumoral ao fornecer sinais inibitórios ou estimuladores de crescimento tumoral. Em locais distantes do tumor primário, células não tumorais também podem se instalar para preparar os futuros sítios metastáticos que suportam o estabelecimento e a sobrevivência de células metastáticas. Além da comunicação direta célula-célula, fatores solúveis desempenham um papel fundamental na interação entre células tumorais e não tumorais. Destes, as vesículas extracelulares (VEs) representam novos componentes da comunicação célula-célula na formação de microambientes tumorais. VEs são vesículas liberadas por células procarióticas e eucarióticas, estando envolvidas em vários processos fisiológicos e patológicos. Microvesículas e exossomas são tipos prevalentes de VEs em biofluidos, sendo as microvesículas geradas pelo brotamento direto para fora da membrana plasmática e variam em tamanho de ∼100 a 1.000 nm e os exossamos originários de endossomas, tendo uma faixa de tamanho de ∼30 a 150 nm de diâmetro. Independentemente do tipo, os VEs podem abrigar biomoléculas, como proteínas, DNAs, RNAs mensageiros, microRNAs e outros RNAs. Devido à sua carga e capacidade de transferir informações tanto localmente quanto para locais distantes, VEs tem sido consideradas “agentes transdutores de sinal”. Recentemente descrevemos um novo circuito pro-metastático no qual VEs derivados do cancro pancreático induzem a formação de nichos pré-metastáticos do fígado (NPMF) que promovem o desenvolvimento metastático. Especificamente, demonstramos que VEs derivados de CP desempenham um papel fundamental na iniciação de NPMF por serem especificamente absorvidos por células de Kupffer (CK) no fígado, onde ativam as vias fibróticas e promovem um meio pró-inflamatório que, em última análise, suporta metástases. Além disso, mostramos que o fator inibidor da migração de macrófagos (MIF) presente em VEs de CP induz a liberação do fator de crescimento transformador β (TGF-β) por CKs, que, por sua vez, promove a ativação e a produção de fibronectina pelas células estreladas hepáticas. Os depósitos de fibronectina subsequentemente promovem o ancoramento de células CD11b+ derivadas da MO no fígado, completando a formação do NPMF. Embora tenhamos mostrado que as células MO são um componente chave do NPMF, ainda não se sabe se as VEs de CP têm um potencial efeito direto nas células MO e em seus fenótipos. Considerando que virtualmente qualquer célula do corpo é um alvo potencial para essas mensagens derivadas de tumor, a identificação de novos circuitos celulares induzidos por VEs derivados de tumor ajudará a elucidar ainda mais os mecanismos celulares envolvidos em doenças oncológicas. Neste trabalho, mostramos que VEs de CP se ligam preferencialmente a células CD11b+ da MO e induzem a expansão dessa população de células. Além disso, os VEs de CP induzem alterações fenotípicas nas células CD11b+ da MO com potencial relevância para a dinâmica dos microambientes tumorais. Juntos, esses resultados demonstram a existência de um eixo de comunicação entre CP e a MO mediado por VEs com um papel potencial em microambientes tumorais de CP.
Joana Maia1,2, Andreia Hanada Otake1,3, Juliana Poças4,5,6, Ana Sofia Carvalho7, Hans Christian Beck8, Ana Magalhães4,5, Rune Matthiesen7, Maria Carolina Strano Moraes1 and Bruno Costa-Silva1
1-Champalimaud Centre for the Unknown, Champalimaud Foundation, Lisbon, Portugal
2-Graduate Program in Areas of Basic and Applied Biology, University of Porto, Porto, Portugal
3-Center for Translational Research in Oncology, Instituto do Câncer do Estado de São Paulo, Hospital das Clínicas, Faculdade de Medicina da Universidade de São Paulo, São Paulo, Brazil
4-i3S – Instituto de Investigação e Inovação em Saúde, Universidade do Porto, Porto, Portugal
5-IPATIMUP – Instituto de Patologia e Imunologia Molecular da Universidade do Porto, Porto, Portugal
6-Instituto de Ciências Biomédicas Abel Salazar, University of Porto, Porto, Portugal
7-Computational and Experimental Biology Group, CEDOC, Chronic Diseases Research Centre, NOVA Medical School, Faculdade de Ciencias Medicas, Universidade NOVA de Lisboa, Lisbon, Portugal
8-Centre for Clinical Proteomics, Department of Clinical Biochemistry and Pharmacology, Odense University Hospital, Odense, Denmark
Pancreatic cancers (PC) are highly metastatic with poor prognosis, mainly due to delayed detection. We previously showed that PC-derived extracellular vesicles (EVs) act on macrophages residing in the liver, eliciting extracellular matrix remodeling in this organ and marked hepatic accumulation of CD11b+bone marrow (BM) cells, which support PC liver metastasis. We here show that PC-EVs also bind to CD11b+ BM cells and induce the expansion of this cell population. Transcriptomic characterization of these cells shows that PC-EVs upregulate IgG and IgA genes, which have been linked to the presence of monocytes/macrophages in tumor microenvironments. We also report here the transcriptional downregulation of genes linked to monocyte/macrophage activation, trafficking, and expression of inflammatory molecules. Together, these results show for the first time the existence of a PC–BM communication axis mediated by EVs with a potential role in PC tumor microenvironments.
Frontiers in Cell Developmental Biology
https://www.frontiersin.org/articles/10.3389/fcell.2020.592518/full




