Associação Portuguesa de Investigação em Cancro
Combinação de técnicas de bioimagem e microscopia permite prever a agressividade das células tumorais da mama
Combinação de técnicas de bioimagem e microscopia permite prever a agressividade das células tumorais da mama
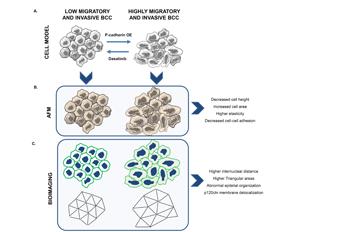
O reconhecimento das propriedades biomecânicas das células tumorais permite compreender os mecanismos físicos responsáveis pelo processo metastático. As Caderinas, que são moléculas que promovem a adesão célula-célula, desempenham um papel crucial durante a progressão tumoral. No entanto, na maioria dos estudos, não existem dados que liguem a sinalização pro-tumorigénica e as variações no equilíbrio mecânico mediado pelas forças de adesão promovidas pelas caderinas. Com o objetivo de quantificar as modificações biomecânicas das células tumorais que se associam a um comportamento mais invasivo e agressivo, neste trabalho descreve-se a utilização de microscopia de força atómica e imagens de fluorescência para análise das redes intercelulares, com o objectivo de prever a força de adesão célula-célula. De uma forma mais detalhada, a equipa liderada por Joana Paredes, que se tem dedicado ao estudo da caderina-P como um biomarcador de agressividade tumoral e de mau prognóstico para as doentes com cancro da mama, demonstrou que células tumorais com ativação da via de sinalização da caderina-P/Src modificam as suas propriedades biomecânicas, diminuindo a adesão célula-célula e aumentando a invasão celular. Notavelmente, a inibição da sinalização de Src, utilizando dasatinib (uma droga já aprovada pela FDA), reverteu os efeitos induzidos pela caderina-P, promovendo a adesão célula-célula e diminuindo a invasão celular. Em conclusão, a combinação destas duas ferramentas é capaz de quantificar as modificações biomecânicas das células tumorais, ajudando a prever o seu comportamento invasivo e agressivo. O estudo, que foi publicado no Nanoscale journal, resulta de uma colaboração entre o grupo de Joana Paredes (no i3S, no Porto) com o grupo de Nuno Correia Santos (no IMM, em Lisboa), e a equipa de João Sanches (no ISR-IST, em Lisboa).
AS Ribeiro1,2, FA Carvalho3, J Figueiredo1,2, R Carvalho1, T Mestre4, J Monteiro1, AF Guedes3, M Fonseca4, J Sanches4, R Seruca1,2,5, NC Santos3, J Paredes1,2,5
1 i3S - Instituto de Investigação e Inovação em Saúde, Universidade do Porto, Portugal;
2 Institute of Molecular Pathology and Immunology of the University of Porto;
3 Instituto de Medicina Molecular, Faculdade de Medicina, Universidade de Lisboa, Lisbon, Portugal;
4 IST-ISR, Lisbon, Portugal; 5Medical Faculty of the University of Porto, Porto, Portugal;
Physical forces mediated by cell-cell adhesion molecules, as cadherins, play a crucial role in preserving normal tissue architecture. Accordingly, altered cadherins’ expression has been documented as a common event during cancer progression. However, in most studies, no data exists linking pro-tumorigenic signaling and variations in the mechanical balance mediated by adhesive forces. In breast cancer, P-cadherin overexpression increases in vivo tumorigenic ability, as well as in vitro cell invasion, by activating Src family kinase (SFK) signalling. Though, it is not known how P-cadherin and SKF activation impact cell-cell biomechanical properties. In the present work, using atomic force microscopy (AFM) images, cell stiffness and cell-cell adhesion measurements, and undirected graph analysis based on microscopic images, we demonstrated that P-cadherin overexpression promotes significant alterations in cell’s morphology, by decreasing cellular height and increasing its area. It also affects biomechanical properties, by decreasing cell-cell adhesion and cell stiffness. Further, cellular network analysis showed alterations in intercellular organization, which associates with cell-cell adhesion dysfunction, destabilization of E-cadherin/p120ctn membrane complex and with increased cell invasion. Remarkably, inhibition of SFK signaling, using dasatinib, reverted the pathogenic P-cadherin induced effects, by increasing cell’s height, cell-cell adhesion and cell stiffness, and generating more compact epithelial aggregates, as quantified by intercellular network analysis. In conclusion, P-cadherin/SFK signalling induces topological, morphological and biomechanical cell-cell alterations which are associated to more invasive breast cancer cells. These effects could be further reverted by dasatinib treatment, demonstrating the applicability of AFM and cell network diagrams for measuring epithelia biomechanical properties and structural organization.
Revista: Nanoscale journal
http://pubs.rsc.org/en/Content/ArticleLanding/2016/NR/C6NR04465D#!divAbstract




